UDI(醫(yī)療器械唯一標(biāo)識(shí)碼)解讀
發(fā)布時(shí)間:2023-05-23來(lái)源:長(zhǎng)春艾迪爾醫(yī)用科技發(fā)展有限公司
一、UDI法規(guī)基礎(chǔ)介紹
中國(guó)UDI的“基本法”是《醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)規(guī)則》,這個(gè)規(guī)則是2019年8月發(fā)布的。其基本目的是為了貫徹落實(shí)《國(guó)務(wù)院辦公廳關(guān)于印發(fā)治理高值醫(yī)用耗材改革方案的通知》(國(guó)辦發(fā)〔2019〕37號(hào)),規(guī)范醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)建設(shè),加強(qiáng)醫(yī)療器械全生命周期管理。
首先回顧一下中國(guó)醫(yī)療器械UDI實(shí)施的一些關(guān)鍵時(shí)間點(diǎn):
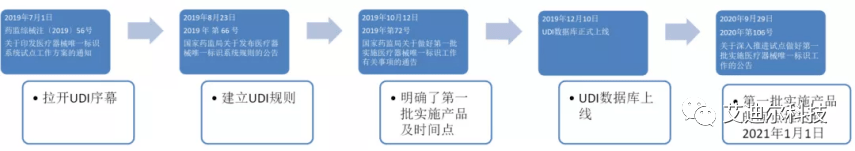
2019年7月——【藥監(jiān)綜械注〔2019〕56號(hào)】 關(guān)于印發(fā)醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)試點(diǎn)工作方案的通知: 拉開了中國(guó)UDI的序幕 ;
2019年8月——【2019年第66號(hào)】國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)規(guī)則的公告: 中國(guó)UDI的規(guī)則被正式建立 ;
2019年10月——【2019年第72號(hào)】國(guó)家藥監(jiān)局關(guān)于做好第一批實(shí)施醫(yī)療器械唯一標(biāo)識(shí)工作有關(guān)事項(xiàng)的通告:明確了第一批實(shí)施產(chǎn)品及其時(shí)間點(diǎn);
2019年12月—— UDI數(shù)據(jù)庫(kù)正式上線 ;
2020年9月——【2020年第106號(hào)】關(guān)于深入推進(jìn)試點(diǎn)做好第一批實(shí)施醫(yī)療器械唯一標(biāo)識(shí)工作的公告: 第一批實(shí)施產(chǎn)品時(shí)間點(diǎn)推遲到2021年1月1日 。
二、什么是UDI?
唯一器械標(biāo)識(shí)(Unique Device Identification,縮寫UDI),醫(yī)療器械唯一標(biāo)識(shí)是指呈現(xiàn)在醫(yī)療器械產(chǎn)品或者包裝上的由數(shù)字、字母或者符號(hào)組成的代碼,用于對(duì)醫(yī)療器械進(jìn)行唯一性識(shí)別。
UDI可以被看作醫(yī)療器械產(chǎn)品在供應(yīng)鏈中的唯一“身份證”, 應(yīng)包括產(chǎn)品標(biāo)識(shí)和生產(chǎn)標(biāo)識(shí)。產(chǎn)品標(biāo)識(shí)為識(shí)別注冊(cè)人/備案人、醫(yī)療器械型號(hào)規(guī)格和包裝的唯一代碼;生產(chǎn)標(biāo)識(shí)由醫(yī)療器械生產(chǎn)過(guò)程相關(guān)信息的代碼組成,根據(jù)監(jiān)管和實(shí)際應(yīng)用需求,可包含醫(yī)療器械序列號(hào)、生產(chǎn)批號(hào)、生產(chǎn)日期、失效日期等。

三、什么是UDI數(shù)據(jù)載體?
UDI數(shù)據(jù)載體,是 指存儲(chǔ)或者傳輸醫(yī)療器械唯一標(biāo)識(shí)的數(shù)據(jù)媒介 , 其應(yīng)當(dāng)滿足自動(dòng)識(shí)別和數(shù)據(jù)采集技術(shù)以及人工識(shí)讀的要求,通俗來(lái)說(shuō)就要包括兩部分:一部分是 機(jī)器可讀 ,其形式可以為 一維碼、二維碼或者射頻標(biāo)簽 ;另外一部分是 人工可讀 ,即應(yīng)為數(shù)字和/或字母的形式。

四、什么是UDI數(shù)據(jù)庫(kù)?
UDI數(shù)據(jù)庫(kù),是 指儲(chǔ)存 醫(yī)療器械唯一標(biāo)識(shí)的 產(chǎn)品標(biāo)識(shí) 與 關(guān)聯(lián)信息 的 數(shù)據(jù)庫(kù) 。與美國(guó)的GUDID系統(tǒng)和歐盟的UDI數(shù)據(jù)庫(kù)類似,該數(shù)據(jù)庫(kù)對(duì)公眾開放,供公眾查詢。藥監(jiān)局負(fù)責(zé)建立及維護(hù)該數(shù)據(jù)庫(kù); 注冊(cè)人 /備案人 應(yīng)在產(chǎn)品上市銷售前,將產(chǎn)品標(biāo)識(shí)(DI)及相關(guān)數(shù)據(jù)上傳至該數(shù)據(jù)庫(kù) ,并 維護(hù)更新相關(guān)數(shù)據(jù) 。
五、發(fā)碼機(jī)構(gòu)是什么?中國(guó)有哪些認(rèn)可的發(fā)碼機(jī)構(gòu)?
器械唯一標(biāo)識(shí)的發(fā)碼機(jī)構(gòu)應(yīng)當(dāng)為中國(guó)境內(nèi)的法人機(jī)構(gòu) ,具備完善的管理制度和運(yùn)行體系,確保按照其標(biāo)準(zhǔn)創(chuàng)建的醫(yī)療器械唯一標(biāo)識(shí)的唯一性,并符合我國(guó)數(shù)據(jù)安全有關(guān)要求。
發(fā)碼機(jī)構(gòu)應(yīng)當(dāng)向注冊(cè)人/備案人提供執(zhí)行其標(biāo)準(zhǔn)的流程并指導(dǎo)實(shí)施,為便于注冊(cè)人/備案人等掌握發(fā)碼機(jī)構(gòu)的編碼標(biāo)準(zhǔn),供相關(guān)方選擇或應(yīng)用,發(fā)碼機(jī)構(gòu)應(yīng)當(dāng)將其編碼標(biāo)準(zhǔn)上傳至醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)并動(dòng)態(tài)維護(hù)。
目前中國(guó)認(rèn)可的發(fā)碼機(jī)構(gòu)有三家:

六、UDI實(shí)施準(zhǔn)備
熟悉UDI的基本法《規(guī)則》、持續(xù)跟蹤UDI的相關(guān)法規(guī):
就目前來(lái)說(shuō),監(jiān)管部門只公布了第一批UDI實(shí)施目錄和實(shí)施時(shí)間,當(dāng)前目錄中涵蓋的是III類高風(fēng)險(xiǎn)器械,包括:有源手術(shù)器械、無(wú)源手術(shù)器械、神經(jīng)和心血管手術(shù)器械、醫(yī)用成像器械、輸血、透析和體外循環(huán)器械、有源植入器械、無(wú)源植入器械、注輸、護(hù)理和防護(hù)器械、眼科器械等共9大類產(chǎn)品,具體產(chǎn)品類別見(jiàn)國(guó)家藥監(jiān)局/國(guó)家衛(wèi)生健康委/國(guó)家醫(yī)保局公告(2020年 第106號(hào)),實(shí)施時(shí)間為2021年1月1日。
熟悉UDI相關(guān)標(biāo)準(zhǔn):
與UDI相關(guān)的標(biāo)準(zhǔn),主要包括:

選擇合適的發(fā)碼機(jī)構(gòu):
如果只考慮中國(guó)市場(chǎng),我們可以選擇前文中三家發(fā)碼機(jī)構(gòu)中的任何一家。但由于不少器械的銷售市場(chǎng)不僅僅局限于國(guó)內(nèi)。在這種情況下,我們發(fā)碼機(jī)構(gòu)的選擇就要兼顧到海外監(jiān)管部門的要求(美國(guó)、歐盟)。
下表是目前歐盟和美國(guó)監(jiān)管部門認(rèn)可的發(fā)碼機(jī)構(gòu)。
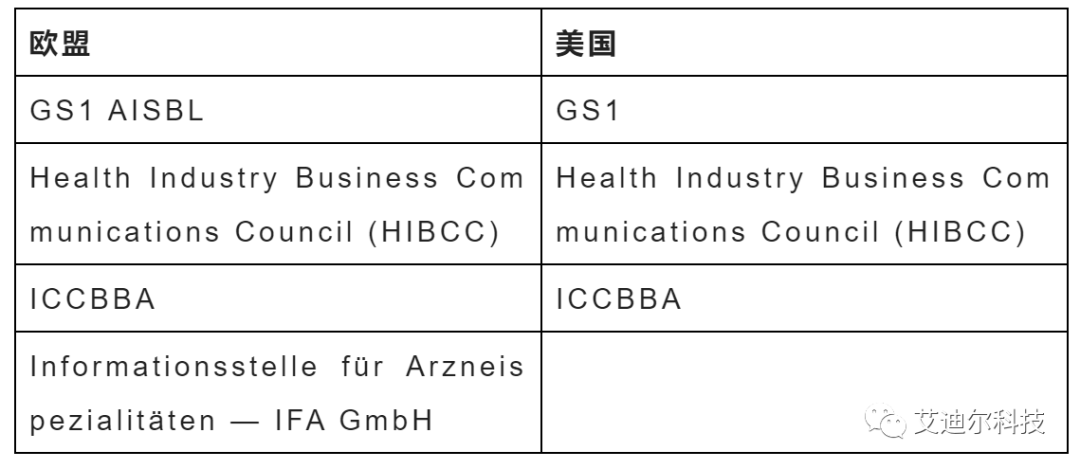
由此我們可以看出,只有GS1一家機(jī)構(gòu)能同時(shí)滿足中國(guó)、歐盟和美國(guó)的要求。(下文如果沒(méi)有特別說(shuō)明,就以GS1來(lái)舉例)
申請(qǐng)注冊(cè)人備案人識(shí)別代碼
注冊(cè)人備案人識(shí)別代碼通常有7~10位數(shù)字組成,這個(gè)代碼可追溯到某個(gè)特定注冊(cè)人備案人。注冊(cè)人備案人代碼前三位是前綴碼,國(guó)際物品編碼協(xié)會(huì)已經(jīng)分配給中國(guó)GS1的前綴碼為690-699。我們?cè)谏暾?qǐng)的時(shí)候可以參考GS1的官網(wǎng),在GS1的官網(wǎng)上面給了比較清楚的步驟,如下:
確定UDI的組成:
我們之前已經(jīng)了解到:醫(yī)療器械唯一標(biāo)識(shí)包括產(chǎn)品標(biāo)識(shí)和生產(chǎn)標(biāo)識(shí), 即UDI=產(chǎn)品標(biāo)識(shí)(DI)+生產(chǎn)標(biāo)識(shí)(PI)。
UDI的結(jié)構(gòu)示意圖如下(摘自YY/T 1630-2018 附錄A):
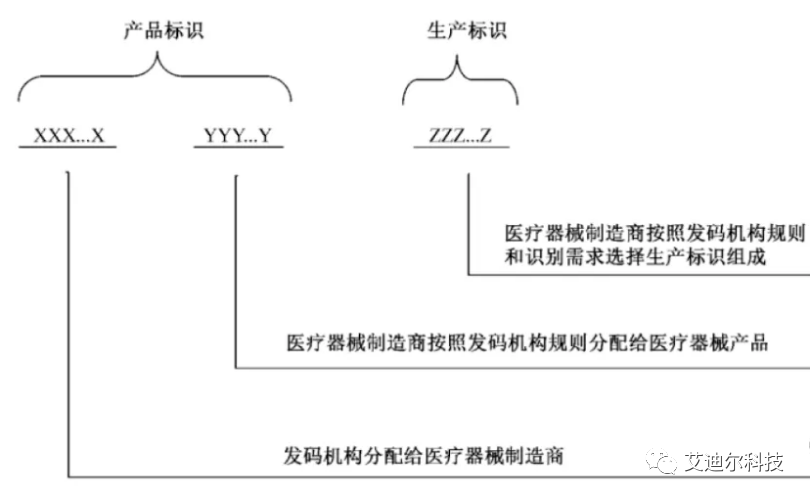
上面的產(chǎn)品標(biāo)識(shí)和生產(chǎn)標(biāo)示只是一個(gè)示意圖,DI和PI可以是串聯(lián),也可以并聯(lián)的。下面是兩個(gè)不同廠家的UDI示例,供參考。


UDI規(guī)則和GS1的標(biāo)準(zhǔn)的對(duì)應(yīng)關(guān)系如下:
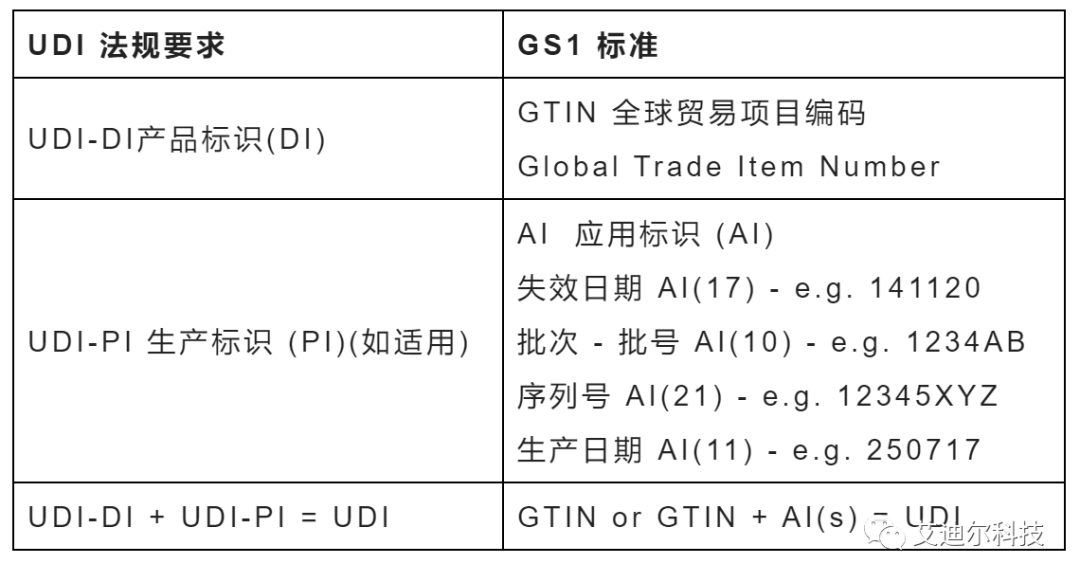
產(chǎn)品標(biāo)識(shí)UDI-DI:
UDI-DI是一個(gè)靜態(tài)信息,用來(lái)指明供應(yīng)鏈中某個(gè)醫(yī)療器械的身份信息。在中國(guó),GB 12904中規(guī)定了商品條碼即GTIN的表示方法。對(duì)于醫(yī)療器械,最常見(jiàn)的表示方法為GTIN-14,下面我們就以GTIN-14來(lái)舉例:

上圖GTIN-14的第一位(D1)為指示位(indicator),用來(lái)指示不同的包裝等級(jí);剩下的第2到第13位(D2 - D13)分別包括注冊(cè)人備案人識(shí)別代碼、商品項(xiàng)目代碼;最后一位(D14)為校驗(yàn)碼。
注冊(cè)人備案人識(shí)別代碼 由7-10位數(shù)字組成,由中國(guó)編碼中心負(fù)責(zé)分配和管理。注冊(cè)人備案人識(shí)別的前3位為前綴碼,前綴碼由國(guó)際物品編碼協(xié)會(huì)分配給中國(guó)。
商品代碼由5-2位數(shù)字組成,一般注冊(cè)人備案人可自行編制。
校驗(yàn)碼有1位數(shù)字,用于檢驗(yàn)整個(gè)編碼的正誤。校驗(yàn)碼可以自行計(jì)算,其方法可以參考標(biāo)準(zhǔn)GB12904-2008的附錄B。從實(shí)操角度來(lái)說(shuō),目前很多編碼軟件能自動(dòng)計(jì)算產(chǎn)生。
生產(chǎn)標(biāo)識(shí) UDI-PI:
UDI-PI對(duì)應(yīng)于GS1標(biāo)準(zhǔn)來(lái)講即為應(yīng)用標(biāo)識(shí)符。它是一個(gè)動(dòng)態(tài)信息,其內(nèi)容通常為序列號(hào)、批號(hào)、生產(chǎn)日期和有效期(失效日期)等;它屬于某個(gè)特定醫(yī)療器械的動(dòng)態(tài)附加信息,可以跟蹤到具體的產(chǎn)品或者批次。
根據(jù)《GB/T 16986-2018 商品條碼 應(yīng)用標(biāo)識(shí)符 》,應(yīng)用標(biāo)識(shí)符常見(jiàn)格式如下:

建議醫(yī)療器械廠家根據(jù)自己的實(shí)際情況(以滿足追溯的要求)來(lái)確定產(chǎn)品的生產(chǎn)標(biāo)識(shí)信息。例如:
1、對(duì)于要求追溯到批次的器械,由DI聯(lián)合PI中的生產(chǎn)日期/有效期、批號(hào)實(shí)現(xiàn)。
2、對(duì)于要求追溯到單品的醫(yī)療器械,由DI聯(lián)合PI中的生產(chǎn)日期/有效期、序列號(hào)實(shí)現(xiàn)。
七、UDI標(biāo)簽生成
在產(chǎn)品完成GTIN(UDI-DI)分配,同時(shí)確定了產(chǎn)品的生產(chǎn)標(biāo)識(shí) UDI-PI后,下一步的動(dòng)作就是生成UDI標(biāo)簽。按照中國(guó)法規(guī)的要求,UDI應(yīng)包括兩個(gè)部分:
(1)機(jī)器可讀碼,目前最為常見(jiàn)的形式就是一維碼和(或)二維碼。(注冊(cè)人備案人可以根據(jù)自己的產(chǎn)品實(shí)際情況選擇合適的UDI載體)。
(2)人工可讀,即為數(shù)字和字母組合。
怎么產(chǎn)生一維碼、二維碼?現(xiàn)在市面上有很多現(xiàn)成軟件能自動(dòng)產(chǎn)生一維碼、二維碼,也有很多這方面的廠家提供服務(wù),可以基于自己的實(shí)際情況去選擇適合自己的方法。
在生成完一維碼、二維碼后,注冊(cè)人備案人需要對(duì)現(xiàn)有標(biāo)簽進(jìn)行標(biāo)簽變更。之后就可以完成UDI標(biāo)簽打印及UDI標(biāo)簽的檢驗(yàn),標(biāo)簽檢驗(yàn)的目的就是保證UDI可以在整個(gè)流通領(lǐng)域的可讀性。
在完成上面的動(dòng)作后,我們是否就能滿足中國(guó)UDI的要求?是否就能把UDI標(biāo)簽貼在產(chǎn)品上去上市流通了呢?當(dāng)然不是。
八、UDI數(shù)據(jù)上傳
產(chǎn)品要上市流通,還要完成下面的環(huán)節(jié):
(1)注冊(cè)人備案人應(yīng)當(dāng)在申請(qǐng)醫(yī)療器械注冊(cè) 、 注冊(cè)變更或者辦理備案時(shí) , 在注冊(cè)/備案管理系統(tǒng)中提交其產(chǎn)品標(biāo)識(shí) (UDI-DI)。注意:產(chǎn)品在UDI實(shí)施日前,已生產(chǎn)銷售的醫(yī)療器械可不具備醫(yī)療器械唯一(UDI)標(biāo)識(shí)。
(2)注冊(cè)人備案人在銷售產(chǎn)品之前 ,應(yīng)確保產(chǎn)品標(biāo)識(shí)和相關(guān)數(shù)據(jù)上傳至中國(guó)醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)(UDID) 。同樣的這也是針對(duì)已經(jīng)實(shí)施UDI的產(chǎn)品,對(duì)尚未列入實(shí)施目錄的產(chǎn)品不強(qiáng)制要求。
相關(guān)數(shù)據(jù)是什么?相關(guān)數(shù)據(jù)包括哪些內(nèi)容?請(qǐng)參考標(biāo)準(zhǔn)《YY/T 1752-2020 醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)基本數(shù)據(jù)集》。里面對(duì)于每個(gè)數(shù)據(jù)集都有相關(guān)的解釋。
怎么填報(bào)呢?請(qǐng)參考標(biāo)準(zhǔn)《YY/T 1753-2020 醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫(kù)填報(bào)指南》。具體操作可以通過(guò)國(guó)家藥品監(jiān)督管理局網(wǎng)上辦事大廳實(shí)現(xiàn)系統(tǒng)登錄操作。
完成以上的動(dòng)作,可以認(rèn)為該醫(yī)療器械已經(jīng)能滿足中國(guó)UDI的最基本要求。
-------------------------------------------------------------------
醫(yī)療器械規(guī)范化、專業(yè)化是大勢(shì)所趨,長(zhǎng)春艾迪爾擁有專業(yè)的注冊(cè)、報(bào)批、技術(shù)團(tuán)隊(duì),對(duì)產(chǎn)品質(zhì)量嚴(yán)格把關(guān),致力于醫(yī)療器械的研發(fā)生產(chǎn),獨(dú)家專利導(dǎo)尿管、混藥器、內(nèi)窺鏡、霧化吸入器、擴(kuò)張器等多項(xiàng)專利產(chǎn)品被納入第三批UDI名單,涉及領(lǐng)域廣泛,期待與您合作。
聯(lián)系電話:0431-81101798
- 上一個(gè):2024-06-28 09:45:28留言
- 下一個(gè):


